1. Destilación
Es una operación unitaria que consiste en la separación física de una mezcla de dos o más componentes aprovechando las diferencias en sus presiones de vapor o puntos de ebullición y preferentemente ebullirá el componente más volátil de la mezcla.
La destilación es una de las operaciones de masa más ampliamente utilizada en la industria como proceso de separación; ya que desde el punto de vista cinético y termodinámico, ofrece grandes ventajas sobre otros procesos existentes para la separación de una mezcla de fluidos (Rico y col., 2000):
- Tiene un gran potencial para altas velocidades de transferencia de masa, en general; en la destilación no hay materiales inertes o sólidos presentes.
- La eficiencia termodinámica es la más alta que en otros procesos utilizados en la industria química.
1.2. Aplicaciones de la destilación
Las aplicaciones de la destilación son muy diversas. Por ejemplo el oxígeno puro se produce por destilación del aire previamente licuado. Además también se utiliza en la industria de las bebidas alcohólicas para separar el etanol de los demás productos de la fermentación de carbohidratos.
Por otra parte, las mayores unidades se encuentran generalmente en la industria del petróleo para generar: gases ligeros, nafta, gasolina, queroseno, diésel, etc; pero también existen columnas grandes y plantas de destilación muy complicadas en el fraccionamiento de disolventes, en la separación del aire líquido y en los procesos químicos en general.
1.3. Tipos de destilación
La destilación puede llevarse a cabo de modo distintos ya que hay dos tipos básicos de separación:
- En una sola etapa sin reflujo: destilación simple continua/discontinua y la destilación instantánea o de equilibrio.
- En múltiples etapas con reflujo: rectificación continúa y discontinua.
En función de lo comentado anteriormente, se definirá los siguientes tipos de destilación que se abordará en esta unidad:
 1.3.1. Destilación simple: es una operación que consiste en hervir el líquido en un recipiente (caldera) condensando se a parte los vapores que constituirán el destilado, quedando en la caldera el residuo. Esta operación puede llevarse a cabo de forma continua (alimentando a la caldera y extrayendo continuamente residuo) o discontinúa ( con lo que las composiciones del líquido y el vapor van cambiando con el tiempo).
1.3.1. Destilación simple: es una operación que consiste en hervir el líquido en un recipiente (caldera) condensando se a parte los vapores que constituirán el destilado, quedando en la caldera el residuo. Esta operación puede llevarse a cabo de forma continua (alimentando a la caldera y extrayendo continuamente residuo) o discontinúa ( con lo que las composiciones del líquido y el vapor van cambiando con el tiempo).
 1.3.2. Destilación instantánea o de equilibrio: En este proceso parte de la corriente de alimentación se evapora en una cámara de vaporización instantánea para separar el vapor y líquido en equilibrio mutuo. El componente más volátil se concentrara más en el vapor y en general, en este método no se alcanza un alto grado de separación. Se usa para componentes que tienen temperaturas de ebullición muy diferentes.
1.3.2. Destilación instantánea o de equilibrio: En este proceso parte de la corriente de alimentación se evapora en una cámara de vaporización instantánea para separar el vapor y líquido en equilibrio mutuo. El componente más volátil se concentrara más en el vapor y en general, en este método no se alcanza un alto grado de separación. Se usa para componentes que tienen temperaturas de ebullición muy diferentes.
 1.3.3. Destilación con reflujo o fraccionada: Es uno de los tipos más importantes de destilación; es un proceso en el cual se lleva a cabo una serie de etapas de vaporización instantánea de manera que los productos gaseosos y líquidos fluyen a contracorriente. Se lleva a cabo en una columna, donde el vapor que abandona la cabeza de la columna se condensa, y una fracción del líquido condensado se devuelve a la misma, lo que constituye el reflujo, el resto se retira como producto destilado.
1.3.3. Destilación con reflujo o fraccionada: Es uno de los tipos más importantes de destilación; es un proceso en el cual se lleva a cabo una serie de etapas de vaporización instantánea de manera que los productos gaseosos y líquidos fluyen a contracorriente. Se lleva a cabo en una columna, donde el vapor que abandona la cabeza de la columna se condensa, y una fracción del líquido condensado se devuelve a la misma, lo que constituye el reflujo, el resto se retira como producto destilado.
4. Etapas de equilibrio: consideraciones generales
Un equipo industrial no siempre consta de etapas (tales como platos en una columna) que representan etapas de equilibrio. El concepto de etapa de equilibrio ha mosstrado ser útil y es ampliamente utilizado en los procedimientos de diseño, que calculan el número de etapas de equilibrio (tambien llamadas teóricas) que se requieren para la separación.
- Etapas ideales: no tienen existencia física o real. En la misma toman contacto dos o mas corrientes (por ejemplo líquido - gas) y se asumen que abandonan la misma en estado de equilibrio; esto implica que el potencial químico de cada componente resulta equivalente, al igual que la temperatura. En una etapa ideal se debe complir los siguientes criterios:
1. Opera en el estado estacionario y tiene un producto líquido y un producto vapor.
2. Todo el vapor y el líquido en la etapa estan intimamente contactados y perfectamente mezclados.
3. El total de vapor saliendo de la etapa está en equilibrio con el total de líquido saliendo de la etapa.
- Etapas no ideales: etapas que no alcanzan el equilibrio y además su eficiencia depende de las caracteristicas físicas del plato y de los flujos de líquido y vapor. Cabe acotar que las etapas no ideales pueden modelarse usando modelo de etapa ideal, pero se debe encontrar la no idealidad.
Para entender mejor la parte teórica suministrada en este blog, les invito a visualizar el siguiente vídeo ilustrativo de la Universidad Nacional Educación a Distancia acerca de la destilación.
La destilación es una de las operaciones de masa más ampliamente utilizada en la industria como proceso de separación; ya que desde el punto de vista cinético y termodinámico, ofrece grandes ventajas sobre otros procesos existentes para la separación de una mezcla de fluidos (Rico y col., 2000):
- Tiene un gran potencial para altas velocidades de transferencia de masa, en general; en la destilación no hay materiales inertes o sólidos presentes.
- La eficiencia termodinámica es la más alta que en otros procesos utilizados en la industria química.
1.2. Aplicaciones de la destilación
Las aplicaciones de la destilación son muy diversas. Por ejemplo el oxígeno puro se produce por destilación del aire previamente licuado. Además también se utiliza en la industria de las bebidas alcohólicas para separar el etanol de los demás productos de la fermentación de carbohidratos.
Por otra parte, las mayores unidades se encuentran generalmente en la industria del petróleo para generar: gases ligeros, nafta, gasolina, queroseno, diésel, etc; pero también existen columnas grandes y plantas de destilación muy complicadas en el fraccionamiento de disolventes, en la separación del aire líquido y en los procesos químicos en general.
1.3. Tipos de destilación
La destilación puede llevarse a cabo de modo distintos ya que hay dos tipos básicos de separación:
- En una sola etapa sin reflujo: destilación simple continua/discontinua y la destilación instantánea o de equilibrio.
- En múltiples etapas con reflujo: rectificación continúa y discontinua.
En función de lo comentado anteriormente, se definirá los siguientes tipos de destilación que se abordará en esta unidad:
 1.3.1. Destilación simple: es una operación que consiste en hervir el líquido en un recipiente (caldera) condensando se a parte los vapores que constituirán el destilado, quedando en la caldera el residuo. Esta operación puede llevarse a cabo de forma continua (alimentando a la caldera y extrayendo continuamente residuo) o discontinúa ( con lo que las composiciones del líquido y el vapor van cambiando con el tiempo).
1.3.1. Destilación simple: es una operación que consiste en hervir el líquido en un recipiente (caldera) condensando se a parte los vapores que constituirán el destilado, quedando en la caldera el residuo. Esta operación puede llevarse a cabo de forma continua (alimentando a la caldera y extrayendo continuamente residuo) o discontinúa ( con lo que las composiciones del líquido y el vapor van cambiando con el tiempo).
Se usa para la separación de líquidos con puntos de ebullición inferiores a 150 grados a presión atmosférica de impurezas no volátiles o de otros líquidos miscibles que presenten un punto de ebullición al menos 25 grados superior al primero de ellos.
 1.3.2. Destilación instantánea o de equilibrio: En este proceso parte de la corriente de alimentación se evapora en una cámara de vaporización instantánea para separar el vapor y líquido en equilibrio mutuo. El componente más volátil se concentrara más en el vapor y en general, en este método no se alcanza un alto grado de separación. Se usa para componentes que tienen temperaturas de ebullición muy diferentes.
1.3.2. Destilación instantánea o de equilibrio: En este proceso parte de la corriente de alimentación se evapora en una cámara de vaporización instantánea para separar el vapor y líquido en equilibrio mutuo. El componente más volátil se concentrara más en el vapor y en general, en este método no se alcanza un alto grado de separación. Se usa para componentes que tienen temperaturas de ebullición muy diferentes. 1.3.3. Destilación con reflujo o fraccionada: Es uno de los tipos más importantes de destilación; es un proceso en el cual se lleva a cabo una serie de etapas de vaporización instantánea de manera que los productos gaseosos y líquidos fluyen a contracorriente. Se lleva a cabo en una columna, donde el vapor que abandona la cabeza de la columna se condensa, y una fracción del líquido condensado se devuelve a la misma, lo que constituye el reflujo, el resto se retira como producto destilado.
1.3.3. Destilación con reflujo o fraccionada: Es uno de los tipos más importantes de destilación; es un proceso en el cual se lleva a cabo una serie de etapas de vaporización instantánea de manera que los productos gaseosos y líquidos fluyen a contracorriente. Se lleva a cabo en una columna, donde el vapor que abandona la cabeza de la columna se condensa, y una fracción del líquido condensado se devuelve a la misma, lo que constituye el reflujo, el resto se retira como producto destilado.
Se usa para separar componentes líquidos que difieren en menos de 25 grados en su punto de ebullición y cada uno de los componentes separados se les denomina fracciones. Además este tipo de destilación es continúa y permite manipular grandes cantidades de materiales, el reflujo hace posible alcanzar purezas elevadas en los productos destilados (Carrasquero, 2011).
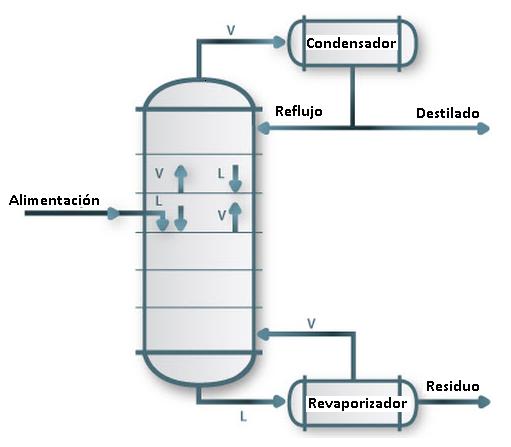
2. Columna de fraccionamiento
Son recipientes cilindricos verticales con una o varias entradas de la corriente de alimentación a destilar por un punto dado de la columna y con una salida en la parte superior o cabeza para extraer los vapores a condensar, estos pueden volver en parte a la columna como reflujo a traves de otra entrada por la cabeza. Asi mismo, se dispone de una salida inferior en la base para retirar los residuos; ademas puede existir tambien salidas laterales en diversos niveles de la columna. En la siguiente figura se muestra el esquema de una columna convencional con sus respectivas zonas y equipos:
Para asegurar un verdadero contacto entre el vapor y el liquido dentro de la columna de fraccionamiento (esencial para la transferencia de masa) se ha diseñado varios disspositivos de laboratorio o industriales, basados principalmente en dos criterios distintos: las columnas de contacto continuo entre el líquido y vapor (columnas de relleno) y las columnas de contacto por etapas (columnas de platos o pisos).
2.1. Reflujo: Es la fracción de líquido condensado que se devuelve a la columna para enriquecer el vapor superior del producto más volátil y garantizar la temperatura más baja en el tope de la misma. "Si no hay reflujo no hay fraccionamiento".
3. Etapa de contacto: el plato
Los platos son superficies planas que dividen la columna en una serie de etapas, tienen por objeto retener una cierta cantidad de líquido en su superficie, a traves de la cual se hace burbujear la vapor que asciende del rehervidos o calderín; consiguiendose así un buen contacto entre el vapor y el líquido. El líquido de un plato cae al plato siguiente por un rebosadero situado en el extremo del plato, según la forma del dsipositivo que permite el paso del vapor a través del líquido; existen una grana variedad de platos entre ellos se pueden mencionar: platos perforados, platos de válvula, platos de capucha, entre otros.
El vapor que llega a un plato por debajo y el líquido que llega por encima, no estan en equilibrio. En cada plato tiene lugar la mezcla de ambas corrientes, produciéndose la transferencia de materia entre el vapor y el líquido y la fuerza impulsora es la diferencia de composiciones entre las corrientes que llegar al plato y las correspondientes de equilibrio a presión y temperatura de esa etapa. En operaciones de normales no se llega a alcanzar el equilibrio entre el líquido y vapor que abandonan el plato, es decir la eficiencia del proceso no es del 100%.
2. Columna de fraccionamiento
Son recipientes cilindricos verticales con una o varias entradas de la corriente de alimentación a destilar por un punto dado de la columna y con una salida en la parte superior o cabeza para extraer los vapores a condensar, estos pueden volver en parte a la columna como reflujo a traves de otra entrada por la cabeza. Asi mismo, se dispone de una salida inferior en la base para retirar los residuos; ademas puede existir tambien salidas laterales en diversos niveles de la columna. En la siguiente figura se muestra el esquema de una columna convencional con sus respectivas zonas y equipos:
Para asegurar un verdadero contacto entre el vapor y el liquido dentro de la columna de fraccionamiento (esencial para la transferencia de masa) se ha diseñado varios disspositivos de laboratorio o industriales, basados principalmente en dos criterios distintos: las columnas de contacto continuo entre el líquido y vapor (columnas de relleno) y las columnas de contacto por etapas (columnas de platos o pisos).
2.1. Reflujo: Es la fracción de líquido condensado que se devuelve a la columna para enriquecer el vapor superior del producto más volátil y garantizar la temperatura más baja en el tope de la misma. "Si no hay reflujo no hay fraccionamiento".
3. Etapa de contacto: el plato
Los platos son superficies planas que dividen la columna en una serie de etapas, tienen por objeto retener una cierta cantidad de líquido en su superficie, a traves de la cual se hace burbujear la vapor que asciende del rehervidos o calderín; consiguiendose así un buen contacto entre el vapor y el líquido. El líquido de un plato cae al plato siguiente por un rebosadero situado en el extremo del plato, según la forma del dsipositivo que permite el paso del vapor a través del líquido; existen una grana variedad de platos entre ellos se pueden mencionar: platos perforados, platos de válvula, platos de capucha, entre otros.
El vapor que llega a un plato por debajo y el líquido que llega por encima, no estan en equilibrio. En cada plato tiene lugar la mezcla de ambas corrientes, produciéndose la transferencia de materia entre el vapor y el líquido y la fuerza impulsora es la diferencia de composiciones entre las corrientes que llegar al plato y las correspondientes de equilibrio a presión y temperatura de esa etapa. En operaciones de normales no se llega a alcanzar el equilibrio entre el líquido y vapor que abandonan el plato, es decir la eficiencia del proceso no es del 100%.
Un equipo industrial no siempre consta de etapas (tales como platos en una columna) que representan etapas de equilibrio. El concepto de etapa de equilibrio ha mosstrado ser útil y es ampliamente utilizado en los procedimientos de diseño, que calculan el número de etapas de equilibrio (tambien llamadas teóricas) que se requieren para la separación.
- Etapas ideales: no tienen existencia física o real. En la misma toman contacto dos o mas corrientes (por ejemplo líquido - gas) y se asumen que abandonan la misma en estado de equilibrio; esto implica que el potencial químico de cada componente resulta equivalente, al igual que la temperatura. En una etapa ideal se debe complir los siguientes criterios:
1. Opera en el estado estacionario y tiene un producto líquido y un producto vapor.
2. Todo el vapor y el líquido en la etapa estan intimamente contactados y perfectamente mezclados.
3. El total de vapor saliendo de la etapa está en equilibrio con el total de líquido saliendo de la etapa.
- Etapas no ideales: etapas que no alcanzan el equilibrio y además su eficiencia depende de las caracteristicas físicas del plato y de los flujos de líquido y vapor. Cabe acotar que las etapas no ideales pueden modelarse usando modelo de etapa ideal, pero se debe encontrar la no idealidad.
Para entender mejor la parte teórica suministrada en este blog, les invito a visualizar el siguiente vídeo ilustrativo de la Universidad Nacional Educación a Distancia acerca de la destilación.



No hay comentarios:
Los comentarios nuevos no están permitidos.